A. IKATAN KIMIA
Ikatan kimia adalah ikatan yang terjadi apabila atom-atom suatu unsur bergabung. ikatan kimia tersebut digunakan untuk membentuk suatu molekul dari dua atom atau lebih. ikatan kimia terbagi menjadi 3 jenis, yaitu ikatan ion, ikatan kovalen, dan ikatan hidrogen.
1. Ikatan ion
Ikatan ion adalah ikatan yang terjadi akibat gaya tarik-menarik antara ion positif dan ion negatif. Ikatan ini terjadi antara unsur logam dan unsur nonlogam. Suatu senyawa yang mengandung ikatan ion disebut senyawa ionik.
Contoh ikatan ion :
NaCl —> Na+ + Cl-
Misalnya pada garam meja (natrium
klorida). Ketika natrium (Na) dan klor (Cl) bergabung, atom-atom natrium
kehilangan elektron, membentuk kation (Na+), sedangkan atom-atom klor menerima elektron untuk membentuk anion (Cl-). Ion-ion ini kemudian saling tarik-menarik dalam rasio 1:1 untuk membentuk natrium klorida.
Na + Cl → Na+ + Cl- → NaCl
Bedasarkan contoh diatas, NaCl terurai menjadi
ion positif (Na+) dan ion negatif (Cl-).
Senyawa ionik memiliki "ciri-ciri ikatan ion" sebagai berikut
:
a.
mempunyai titik didih dan titik leleh tinggi;
b.
berwujud padat pada suhu kamar;
c.
bersifat konduktor dalam keadaan murni.
1.1 Ikatan Ionik
Ikatan
ionik dalam senyawa organik terbentuk melalui trransfer satu atau dua elektron valensi dari satu atom
ke atom lainnya. Atom yang memberikan elektronnya dan menjadi bermuatan positif
disebut kation dan atom yang menerima elektron dan menjadi bermuatan negatif
disebut anion. Contohnya:
Na
+ Cl menjadi Na+
+ Cl-
Atom
natrium hanya memiliki satu elektron valensi. Dengan memberikan elektron itu
tercapailah susunan elektron neon. Pada saat yang sama, ia menjadi bermuatan
positif, yaitu kation natrium. Atom klorin mempunyai 7 elektron valensi. Dengan
menerima 1 elektron tambahan dari Na maka tercapailah susunan elektron argon dan ia menjadi
bermuatan negatif, yaitu anion klorida. Atom elektropositif (Na) berperan
memberikan elektron dan membentuk kation. Sedangkan atom elektronegatif (Cl)
berperan menerima elektron dan membentuk anion.
2. IKATAN KOVALEN
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
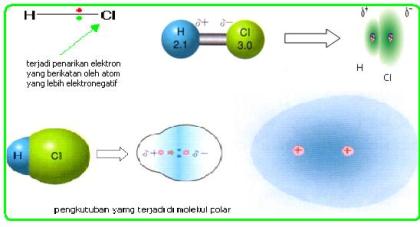
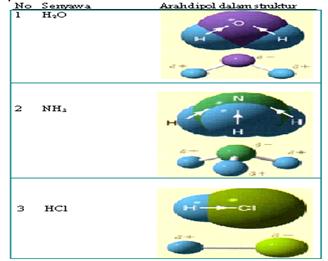
2.2 Ikatan kovalen polar
Ikatan kovalen polar adalah suatu ikatan kovalen dimana elektron-elektron yang membentuk ikatan lebih banyak menghabiskan waktunya untuk berputar dan berkeliling disekitar salah satu atom. Pada molekul HCl elektron yang berikatan akan lebih dekat kepada atom klor dari pada Hidrogen. Polaritas ikatan ini dapat digambarkan dalam bentuk panah atau symbol δ+ , δ-. δ+ adalah tanda bahwa atom lebih bersifat elektropositif di banding dengan atom yang menjadi pasangannya. δ- berarti bahaw atom lebih bersifat elektronegatif dari pada atom yang menjadi pasangan ikatannya. Lihat harga kelektronegtaifan tiap unsur pada tabel pauling
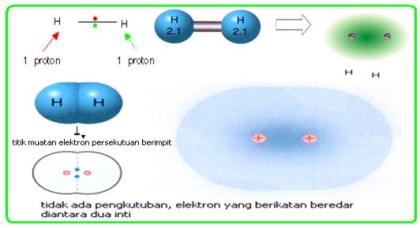
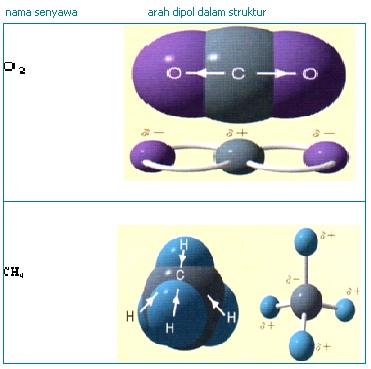
Ikatan kovalen nonpolar (non polar) adalah memiliki ciri Titik muatan negatif elektron persekutuan berhimpit, sehingga pada molekul pembentukuya tidak terjadi momen dipol, dengan perkataan lain bahwa elektron persekutuan mendapat gaya tarik yang sama.
Struktur H2 dan CO2 adalah contoh ikatan kimia non polar karena daya tariknya seimbang baik antara H dengan H atau antar O dengan C kiri dan kanan seimbang. Sehingga momen dipolnya menjadi nol Contoh lain adalah senyawa CH4, H2, O2, Br2 dan lain-lain.
3. Ikatan Kovalen Koordinasi
Pasangan elektron ikatan (PEI) yang menyatakan ikatan dativ digambarkan dengan tanda anak panah kecil yang arahnya dari atom donor menuju akseptor pasangan elektron.
Contoh 1:Terbentuknya senyawa BF3-NH3

Rumus Lewis
Contoh 2:
Terbentuknya senyawa NH4+
Terbentuknya senyawa NH4+
4. IKATAN LOGAM
Atom-atom logam dapat diibaratkan seperti bola pingpong yang terjejal rapat 1 sama lain.Atom logam mempunyai sedikit elektron valensi, sehingga sangat mudah untuk dilepaskan dan membentuk ion positif. Maka dari itu kulit terluar atom logam relatif longgar (terdapat banyak tempat kosong) sehingga elektron dapat berpindah dari 1 atom ke atom lain.Mobilitas elektron dalam logam sedemikian bebas, sehingga elektron valensi logam mengalami delokalisasi yaitu suatu keadaan dimana elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa berpindah-pindah dari 1 atom ke atom lain.

Elektron-elektron valensi tersebut berbaur membentuk awan elektron yang menyelimuti ion-ion positif logam.
Struktur logam seperti gambar di atas, dapat menjelaskan sifat-sifat khas logam yaitu :
a). berupa zat padat pada suhu kamar, akibat adanya gaya tarik-menarik yang cukup kuat antara elektron valensi (dalam awan elektron) dengan ion positif logam.
b). dapat ditempa (tidak rapuh), dapat dibengkokkan dan dapat direntangkan menjadi kawat. Hal ini akibat kuatnya ikatan logam sehingga atom-atom logam hanya bergeser sedangkan ikatannya tidak terputus.
c). penghantar / konduktor listrik yang baik, akibat adanya elektron valensi yang dapat bergerak bebas dan berpindah-pindah. Hal ini terjadi karena sebenarnya aliran listrik merupakan aliran elektron.
5. Ikatan Van der Waals
Gaya
van der Waals dalam ilmu kimia merujuk pada jenis tertentu gaya antar
molekul. Istilah ini pada awalnya merujuk pada semua jenis gaya antar
molekul, dan hingga saat ini masih kadang digunakan dalam pengertian
tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul
dari polarisasi molekul menjadi dipol.
Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas (gaya Debye) serta pergeseran distribusi awan elektron (gaya London).
Nama gaya ini diambil dari nama kimiawan Belanda Johannes van der Waals, yang pertama kali mencatat jenis gaya ini. Potensial Lennard-Jones sering digunakan sebagai model hampiran untuk gaya van der Waals sebagai fungsi dari waktu.
Interaksi van der Waals teramati pada gas mulia, yang amat stabil dan cenderung tak berinteraksi. Hal ini menjelaskan sulitnya gas mulia untuk mengembun. Tetapi, makin besar ukuran atom gas mulia (makin banyak elektronnya) makin mudah gas tersebut berubah menjadi cairan.
Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas (gaya Debye) serta pergeseran distribusi awan elektron (gaya London).
Nama gaya ini diambil dari nama kimiawan Belanda Johannes van der Waals, yang pertama kali mencatat jenis gaya ini. Potensial Lennard-Jones sering digunakan sebagai model hampiran untuk gaya van der Waals sebagai fungsi dari waktu.
Interaksi van der Waals teramati pada gas mulia, yang amat stabil dan cenderung tak berinteraksi. Hal ini menjelaskan sulitnya gas mulia untuk mengembun. Tetapi, makin besar ukuran atom gas mulia (makin banyak elektronnya) makin mudah gas tersebut berubah menjadi cairan.
6. Ikatan Hidrogen
ikatan hidrogen adalah sejenis gaya tarik antarmolekul yang terjadi
antara dua muatan listrik parsial dengan polaritas yang berlawanan.
Walaupun lebih kuat dari kebanyakan gaya antarmolekul, ikatan hidrogen
jauh lebih lemah dari ikatan kovalen dan ikatan ion. Dalam makromolekul
seperti protein dan asam nukleat, ikatan ini dapat terjadi antara dua
bagian dari molekul yang sama. dan berperan sebagai penentu bentuk
molekul keseluruhan yang penting.
Ikatan hidrogen terjadi ketika sebuah molekul memiliki atom N, O, atau F yang mempunyai pasangan elektron bebas (lone pair electron). Hidrogen dari molekul lain akan berinteraksi dengan pasangan elektron bebas ini membentuk suatu ikatan hidrogen dengan besar ikatan bervariasi mulai dari yang lemah (1-2 kJ mol-1) hingga tinggi (>155 kJ mol-1).
Kekuatan ikatan hidrogen ini dipengaruhi oleh perbedaan elektronegativitas antara atom-atom dalam molekul tersebut. Semakin besar perbedaannya, semakin besar ikatan hidrogen yang terbentuk.
Ikatan hidrogen mempengaruhi titik didih suatu senyawa. Semakin besar ikatan hidrogennya, semakin tinggi titik didihnya. Namun, khusus pada air (H2O), terjadi dua ikatan hidrogen pada tiap molekulnya. Akibatnya jumlah total ikatan hidrogennya lebih besar daripada asam florida (HF) yang seharusnya memiliki ikatan hidrogen terbesar (karena paling tinggi perbedaan elektronegatifitasnya) sehingga titik didih air lebih tinggi daripada asam florida.
Ikatan hidrogen terjadi ketika sebuah molekul memiliki atom N, O, atau F yang mempunyai pasangan elektron bebas (lone pair electron). Hidrogen dari molekul lain akan berinteraksi dengan pasangan elektron bebas ini membentuk suatu ikatan hidrogen dengan besar ikatan bervariasi mulai dari yang lemah (1-2 kJ mol-1) hingga tinggi (>155 kJ mol-1).
Kekuatan ikatan hidrogen ini dipengaruhi oleh perbedaan elektronegativitas antara atom-atom dalam molekul tersebut. Semakin besar perbedaannya, semakin besar ikatan hidrogen yang terbentuk.
Ikatan hidrogen mempengaruhi titik didih suatu senyawa. Semakin besar ikatan hidrogennya, semakin tinggi titik didihnya. Namun, khusus pada air (H2O), terjadi dua ikatan hidrogen pada tiap molekulnya. Akibatnya jumlah total ikatan hidrogennya lebih besar daripada asam florida (HF) yang seharusnya memiliki ikatan hidrogen terbesar (karena paling tinggi perbedaan elektronegatifitasnya) sehingga titik didih air lebih tinggi daripada asam florida.





keren, jangan lupa pahami isinya
BalasHapusTerimakasih atas informasinya, saya sekarang lebih tau ikatan kimia
BalasHapusjangan lupa kunjungi https://ppns.ac.id
Tolong isi kuisionernya, semakin banyak yang ngisi semakin banyak juga balasannya. Terimakasih sudah membantu 🙏🏽
https://bit.ly/38P1KV