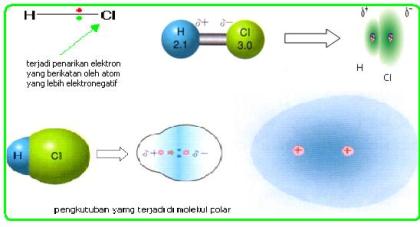
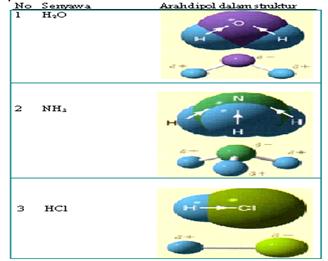
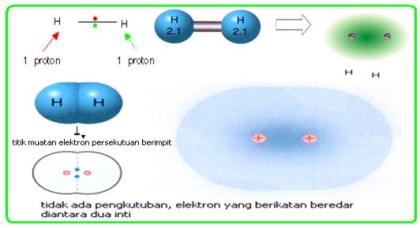
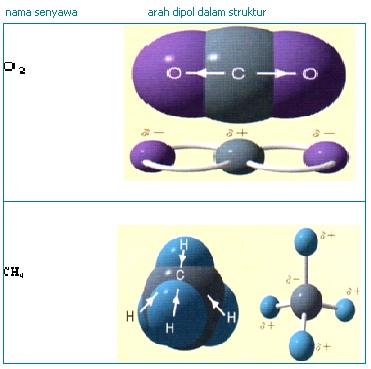
A.Pengertian Ikatan Ion
Ikatan ion adalah ikatan yang terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia. Ion positif dan ion negatif diikat oleh suatu gaya elektrostatik. Senyawa yang dihasilkan disebut senyawa ion.
 |
Struktur NaCl
1 Cl dikelilingi 6 Na dan sebaliknya 1 Na dikelilingi 6 Cl
|
Atom-atom membentuk ikatan ion karena masing-masing atom ingin mencapai keseimbangan/kestabilan seperti struktur elektron gas mulia. Ikatan ion terbentuk antara:
- Ion positif dengan ion negatif,
- Atom-atom berenergi potensial ionisasi kecil dengan atom-atom berafinitas elektron besar (Atom-atom unsur golongan IA, IIA dengan atom-atom unsur golongan VIA, VIIA),
- Atom-atom dengan keelektronegatifan kecil dengan atom-atom yang mempunyai keelektronegatifan besar.
B. Pembentukan Ikatan Ion
Sebagimana disebutkan di atas bahwa ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain. Masih ingat kan sobat, ikatan antar unsur akan stabil jika eletron terluar berjumlah 2 dan 8. Perhatikan contoh pembentukan ikatan ion antara unsur Na (natrium) dan Cl (klorida) berikut ini:
Ikatan ion merupakan ikatan yang relatif kuat. Pada suhu kamar, semua senyawa ion berupa zat padat kristal dengan struktur tertentu. Dengan mengunakan lambang Lewis, pembentukan NaCl digambarkan sebagai berikut.
 |
*Catatan:
Lambang titik elektron Lewis terdiri atas lambang unsur dan titik-titik yang setiap titiknya menggambarkan satu elektron valensi dari atom-atom unsur. Titik-titik elektron adalah elektron terluarnya.
 |
C. Sifat-sifat Ikatan Ion
Selain bersifat relatif kuat, ikatan ion juga memiliki sifat-sifat yang lain, diantaranya adalah sebagai berikut:
- Memiliki titik didih dan titik leleh yang tinggi. Ion positif dan negatif dalam kristal senyawa ion tidak bebas bergerak karena terikat oleh gaya elektrostatik yang kuat. Diperlukan suhu yang tinggi agar ion-ion memperoleh energi kinetik yang cukup untuk mengatasi gaya elektrostatik.
- Keras tetapi rapuh. Bersifat keras karena ion-ion positif dan negatif terikat kuat ke segala arah oleh gaya elektrostatik. Bersifat rapuh dikarenakan lapisan-lapisan dapat bergeser jika dikenakan gaya luar, ion sejenis dapat berada satu di atas yang lainnya sehingga timbul tolak-menolak yang sangat kuat yang menyebabkan terjadinya pemisahan.
- Berupa padatan pada suhu ruang.
- Larut dalam pelarut air, tetapi umumnya tidak larut dalam pelarut organik
- Tidak menghantarkan listrik dalam fasa padat, tetapi menghantarkan listrik dalam fasa cair. Zat dikatakan dapat menghantarkan listrik apabila terdapat ion-ion yang dapat bergerak bebas membawa muatan listrik.
D. VIDEO PROSES TERBENTUKNYA IKATAN IONIK
# VIDEO PERTAMA PROSES TERBENTUKNYA IKATAN IONIK
# VIDEO KEDUA TERBENTUKNYA IKATAN IONIK
IKATAN KOVALEN
Ikatan Kovalen adalah ikatanyang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Pembentukan ikatan kovalen terbentuk dari atom-atom unsur yang memiliki afinitas elektron tinggi serta beda keelektronegatifannya lebih kecil dibandingkan ikatan ion. Atom non logam cenderung untuk menerima elektron sehingga jika tiap-tiap atom non logam berikatan maka ikatan yang terbentuk dapat dilakukan dengan cara mempersekutukan elektronnya dan akhirnya terbentuk pasangan elektron yang dipakai secara bersama. Pembentukan ikatan kovalen dengan cara pemakaian bersama pasangan elektron tersebut harus sesuai dengan konfigurasi elektron pada unsur gas mulia yaitu 8 elektron (kecuali He berjumlah 2 elektron).
Ikatan kovalen koordinasi adalah ikatan kovalen yang terbentuk dengan cara pemakaian bersama pasangan elektron yang berasal dari salah satu atom/ion/molekul yang memiliki PEB. Adapun atom/ion/molekul lain hanya menyediakan orbital kosong.
NH4Cl merupakan salah satu contoh senyawa kovalen koordinasi. Perhatikan kovalen koordinasi pada NH4+ di bawah.
1. Ikatan Kovalen Tunggal
Contoh:
1H = 1
9F = 2, 7
Atom H memiliki 1 elektron valensi sedangkan atom F memiliki 7 elektron valensi. Agar atom H dan F memiliki konfigurasi elektron yang stabil, maka atom H dan atom F masing-masing memerlukan 1 elektron tambahan (sesuai dengan konfigurasi elektron He dan Ne). Jadi, atom H dan F masing-masing meminjamkan 1 elektronnya untuk dipakai bersama.
 |
2. Ikatan Kovalen Rangkap Dua
Contoh:
Ikatan yang terjadi antara atom O dengan O membentuk molekul O2
Konfigurasi elektronnya :
8O= 2, 6
Atom O memiliki 6 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom O memerlukan tambahan elektron sebanyak 2. Ke-2 atom O saling meminjamkan 2 elektronnya, sehingga ke-2 atom O tersebut akan menggunakan 2 pasang elektron secara bersama.
 |
3. Ikatan Kovalen Rangkap Tiga
Contoh:
Ikatan yang terjadi antara atom N dengan N membentuk molekul N2
Konfigurasi elektronnya :
7N = 2, 5
Atom N memiliki 5 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom N memerlukan tambahan elektron sebanyak 3. Ke-2 atom N saling meminjamkan 3 elektronnya, sehingga ke-2 atom N tersebut akan menggunakan 3 pasang elektron secara bersama.
4. Ikatan Kovalen Koordinasi
 |
Senyawa NH4Cl terbentuk dari ion NH4+ dan ion Cl–. Ion NH4+ terbentuk dari molekul NH3 dan ion H+, sedangkan ion H+ terbentuk jika hidrogen melepaskan satu elektronnya.
Ikatan kovalen koordinasi digambarkan dengan lambang elektron yang sama (dua titik). Hal itu menunjukan bahwa pasangan elektron itu berasal dari atom yang sama.
Ikatan kovalen dituliskan dengan tanda (-), sedangkan kovalen koordinasi dituliskan dengan tanda (→). Jika NH4+ berikataan dengan Cl–, akan terbentuk senyawa NH4Cl. Jadi, pada senyawa NH4Cl terdapat tiga jenis ikatan, yaitu tiga ikatan kovalen, satu ikatan kovalen koordinasi, dan satu ikatan ion (antara ion NH4+ dengan ion Cl–). Agar sobat lebih memahami ikatan kovalen koordinasi, pelajarilah pembentukan senyawa-senyawa berikut.
1. Senyawa SO3
Atom
 |
Jadi, dalam senyawa SO3 terdapat satu ikatan rangkap dua ddan ikatan kovalen koordinasi.
2. Senyawa HNO3
Pada penggambaran struktur lewis molekul HNO
Jadi, dalam molekul HNO3 terdapat 3 ikatan kovalen dan 1 ikatan kovalen koordinasi.
 |
5. VIDEO PROSES TERBENTUKNYA IKATAN KOVALEN